Einleitung
Die EU-Bolar-Ausnahme ist ein zentraler Bestandteil des europäischen Patentrechts und spielt eine entscheidende Rolle für die pharmazeutische Industrie. Durch die jüngsten Vorschläge im Rahmen des EU-Pharma-Pakets könnten sich signifikante Änderungen ergeben, die den rechtlichen Rahmen und die strategischen Entscheidungen von Unternehmen beeinflussen. Dieser Artikel beleuchtet die wesentlichen Aspekte der Bolar-Ausnahme, die geplanten Änderungen und ihre Auswirkungen. Kontaktieren Sie unser erfahrenes Biotech-Team bei Michalski Hüttermann & Partner, um zu erfahren, wie Sie sich optimal auf die Änderungen vorbereiten können.
1. Was ist die Bolar-Ausnahme?
Die Bolar-Ausnahme, benannt nach einem wegweisenden US-Fall (Roche vs. Bolar), ermöglicht es pharmazeutischen Unternehmen, Studien und Tests durchzuführen, die für die Zulassung von Generika oder Biosimilars erforderlich sind – und das vor dem Ablauf eines Patents. Diese Ausnahme schützt Unternehmen davor, wegen Patentverletzungen verklagt zu werden, wenn sie diese Studien in der Patentlaufzeit durchführen.
Die Bolar-Ausnahme unterscheidet sich vom allgemeinen Forschungsprivileg, das die Nutzung patentierter Erfindungen für wissenschaftliche Zwecke erlaubt. Während das Forschungsprivileg auf die reine Wissensgenerierung abzielt, erlaubt die Bolar-Ausnahme die Nutzung für spezifische Zulassungsverfahren, was sie für generische und innovative Arzneimittelhersteller gleichermaßen relevant macht.
2. Wichtige Änderungen durch das EU-Pharma-Paket
Das EU-Pharma-Paket umfasst umfassende Reformvorschläge, um den Zugang zu erschwinglichen Medikamenten zu fördern und rechtliche Unsicherheiten abzubauen. Ein zentraler Bestandteil ist die Überarbeitung der Bolar-Ausnahme durch Artikel 85 der vorgeschlagenen Richtlinie.
- Präzisere Definitionen: Artikel 85 definiert klar, welche Studien und Aktivitäten unter die Ausnahme fallen, einschließlich solcher, die zur Zulassung, zur Bewertung durch Health Technology Assessments (HTAs) oder zur Preisfestsetzung erforderlich sind.
- Erweiterte Anwendungsbereiche: Die neuen Regelungen erlauben es, auch Aktivitäten wie Herstellung, Lagerung und Import durch Drittanbieter abzudecken, was vorher oft unklar war.
- Harmonisierung: Ziel ist es, die bislang uneinheitliche Umsetzung der Bolar-Ausnahme in den EU-Mitgliedstaaten zu vereinheitlichen und dadurch die Rechtsunsicherheit zu reduzieren.
Diese Änderungen könnten die Wettbewerbsfähigkeit europäischer Generikahersteller stärken und gleichzeitig den Zugang der Patienten zu bezahlbaren Medikamenten erleichtern.
3. Nationale Unterschiede und rechtliche Unsicherheiten
Die Umsetzung der Bolar-Ausnahme variiert stark zwischen den EU-Mitgliedstaaten, was zu erheblichen rechtlichen Unsicherheiten führt. Beispiele:
- Deutschland: Eine der umfassendsten Implementierungen, die sowohl Generika als auch innovative Medikamente abdeckt und Zulassungen außerhalb der EU erlaubt.
- Belgien und Niederlande: Einschränkungen, beispielsweise bei der Nutzung für innovative Medikamente oder für Zulassungen außerhalb der EU.
- Vereinigtes Königreich: Nach dem Brexit eigene Regelungen, die teils enger gefasst sind.
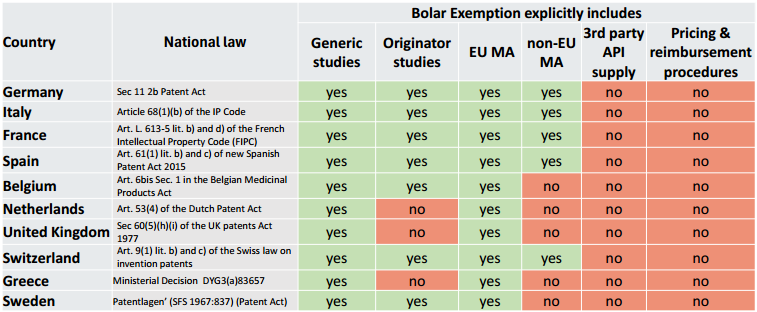
Diese Unterschiede erschweren die Planung und Umsetzung von Studien und Markteintritten erheblich. Sie führen oft zu fragmentierten Lieferketten, Verzögerungen bei Markteinführungen und höheren Compliance-Kosten. Solche Herausforderungen können die Wettbewerbsfähigkeit und Innovationsbereitschaft europäischer Unternehmen beeinträchtigen.
4. Auswirkungen auf strategische Entscheidungen
Die Änderungen im Rahmen des EU-Pharma-Pakets erfordern strategische Anpassungen, sowohl für Hersteller von Generika und Biosimilars als auch für Patentinhaber.
5. Blick in die Zukunft: Was bringt die Revision?
Die Vorschläge des EU-Pharma-Pakets sind ein Schritt in Richtung Harmonisierung und sollen langfristig die Wettbewerbsfähigkeit der europäischen Pharmaindustrie stärken. Laut Zeitplan könnten die Änderungen 2026 in Kraft treten, wobei eine vollständige Umsetzung bis 2028 zu erwarten ist.
Die angestrebte Harmonisierung verspricht:
- Rechtliche Sicherheit: Einheitliche Regelungen erleichtern die strategische Planung und verringern die Risiken für Unternehmen.
- Zugang zu erschwinglichen Medikamenten: Patienten in der EU könnten von niedrigeren Kosten und einem schnelleren Zugang zu Generika und Biosimilars profitieren.
- Stärkung des europäischen Pharma-Marktes: Die klaren Vorgaben könnten die Attraktivität des Standorts Europa für pharmazeutische Unternehmen erhöhen.
Schluss und Call-to-Action
Die Revision der EU-Bolar-Ausnahme markiert eine entscheidende Entwicklung für die pharmazeutische Industrie in Europa. Ob als Generika-Hersteller, Biosimilar-Produzent oder Patentinhaber – Unternehmen stehen vor neuen Herausforderungen, aber auch vor großen Chancen.
Möchten Sie wissen, wie diese Änderungen Ihr Geschäft beeinflussen? Kontaktieren Sie unser erfahrenes Biotech-Team bei Michalski Hüttermann & Partner. Gemeinsam entwickeln wir die richtige Strategie für Ihr Unternehmen.
Kontaktieren Sie gerne den Referenten
Dr. Jan Winkelnkemper

